El tratamiento con una terapia CRISPR personalizada parece haber sido efectivo en un bebé que nació con una enfermedad genética que afectó su capacidad para metabolizar proteínas. Sin embargo, aún no está claro el comportamiento a largo plazo de los tratamientos y si estas terapias a medida podrán aplicarse ampliamente y en forma masiva.
En un avance clave para el desarrollo de las terapias genéticas en el campo de la salud humana, un bebé de nueve meses llamado KJ Muldoon se ha convertido en la primera persona tratada con una terapia de edición genética CRISPR personalizada, diseñada específicamente para corregir una mutación única en su ADN. Los resultados se presentan en un nuevo estudio publicado en la revista The New England Journal of Medicine.
Este logro, concretado por investigadores del Children’s Hospital of Philadelphia (CHOP) y la Universidad de Pensilvania, en Estados Unidos, marca un antes y un después en la medicina genética de precisión y podría abrir el camino a tratamientos similares, enfocados en otras enfermedades metabólicas consideradas raras o inusuales.
Los detalles del tratamiento
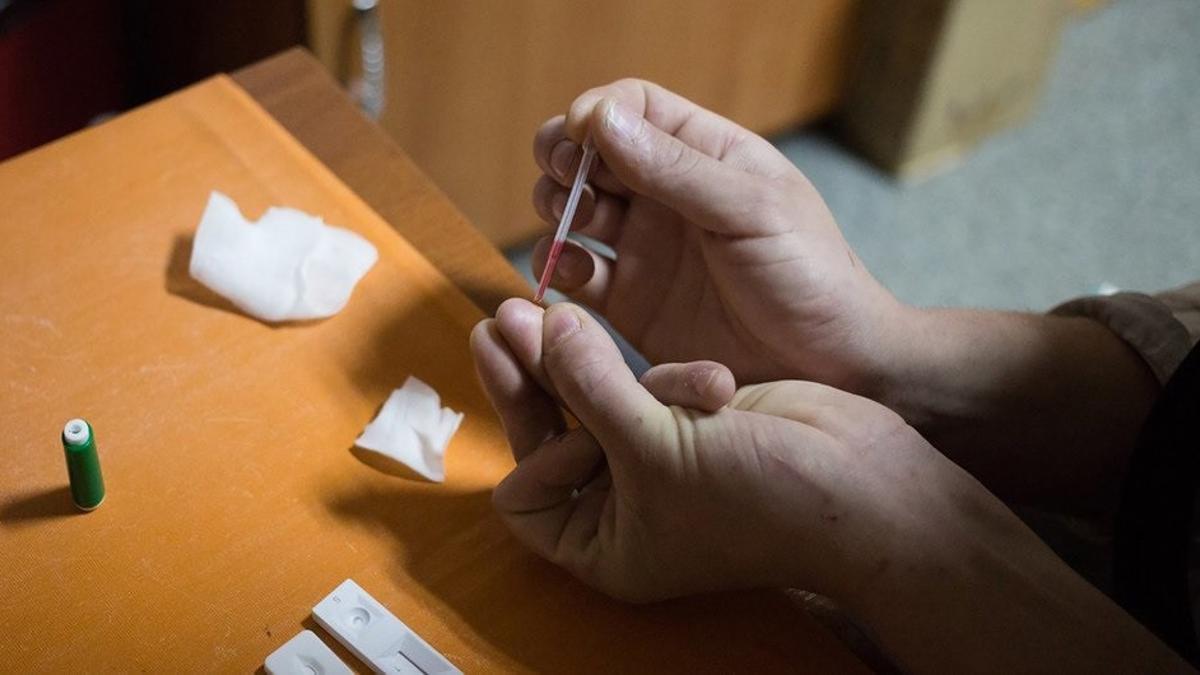
Debido a mutaciones genéticas heredadas de sus padres, el pequeño KJ nació con una deficiencia severa de carbamoil fosfato sintetasa 1 (CPS1), una enfermedad metabólica que compromete su capacidad para procesar los compuestos que contienen nitrógeno, producidos cuando el cuerpo descompone las proteínas. Como consecuencia de esto, su sangre tenía altos niveles de amoníaco, un compuesto que es particularmente tóxico para el cerebro, según un artículo publicado en Nature.
Habitualmente, los pacientes con esta condición requieren trasplantes de hígado, pero debido a la gravedad de su caso y la falta de tratamientos disponibles, los médicos optaron por una solución innovadora: una terapia CRISPR personalizada. Utilizando la técnica de edición genética conocida como «base editing», los científicos diseñaron una terapia específica para corregir la mutación en el gen CPS1 de KJ.
Esta técnica permite realizar cambios precisos en una sola letra del ADN sin cortar la doble hélice, reduciendo los riesgos asociados con otras formas de edición genética. La terapia fue administrada directamente al hígado de KJ mediante nanopartículas lipídicas, que transportaban el ARN guía y las enzimas necesarias para la edición genética.
En tiempo récord
En tan solo seis meses, el equipo de investigadores identificó la mutación específica, diseñó la terapia, la probó en modelos animales y obtuvo la aprobación regulatoria para su uso en seres humanos. Según una nota de prensa, KJ recibió su primera dosis en febrero de 2025, seguida de dos dosis adicionales en marzo y abril. Desde entonces, ha mostrado mejoras significativas en su salud, con una mayor tolerancia a las proteínas y un crecimiento físico adecuado, sin efectos secundarios graves reportados.
Referencia
Patient-Specific In Vivo Gene Editing to Treat a Rare Genetic Disease. Kiran Musunuru et al. The New England Journal of Medicine (2025). DOI:https://www.doi.org/10.1056/NEJMoa2504747
Este caso representa un cambio de paradigma en el tratamiento de enfermedades genéticas raras. Hasta ahora, las terapias genéticas se han centrado principalmente en enfermedades comunes con mutaciones compartidas entre muchos pacientes. La experiencia con KJ demuestra que es posible desarrollar tratamientos personalizados para mutaciones únicas, un avance que podría beneficiar a millones de personas que padecen enfermedades genéticas inusuales y no tienen a disposición opciones terapéuticas efectivas.
Sin embargo, los expertos advierten que aún es temprano para considerar esta terapia como una cura definitiva. Se requiere un seguimiento a largo plazo para evaluar la durabilidad de los efectos y detectar posibles efectos secundarios tardíos. Además, la escalabilidad y el coste de estas terapias personalizadas representan desafíos significativos. Actualmente, los tratamientos basados en CRISPR pueden costar entre 1 y 2 millones de dólares (o una cifra similar en euros) por paciente, limitando su accesibilidad.